| Demócrito, pensador griego del siglo V a.C., retomó los preceptos de su maestro, el filósofo Leucipo, y propuso una teoría "atómica": | La materia está formada por partículas indivisibles ("átomos" en griego). |
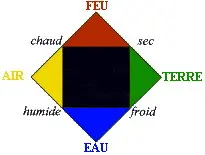
 | En el siglo IV a.C., Empédocles, en contradicción con Demócrito, propuso esta teoría: | el Universo se compone de cuatro elementos:
|
 | Al mismo tiempo, Aristóteles reforzó la teoría de los cuatro elementos de Empédocles atribuyendo cualidades a cada uno de los cuatro elementos fundamentales: frío, seco, caliente y húmedo. Estas características, sumadas de dos en dos, forman los elementos. Estos elementos, a su vez, conforman todo el universo. Esta teoría fue capaz de explicar varios fenómenos físicos. | 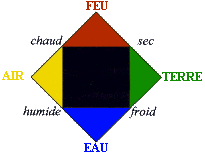 |
| 23 siglos después... | ||
 | En 1808, John Dalton, químico y físico inglés, retomó y amplió la noción de átomo de Demócrito: |
|
 | En 1869, Dimitri Ivanovitch Mendeleïev, profesor de química en San Petersburgo, clasificó los elementos en función de sus propiedades. Mientras escribía un volumen de química, se dio cuenta de que, colocando los elementos en orden ascendente de masa atómica, surgía un patrón de propiedades que se repetía varias veces. | |
 La primera tabla de Mendeleiev | Mendeleiev dispuso su tabla de forma que la periodicidad fuera claramente visible, pero para respetar la ley periódica, en la que creía firmemente, a veces tuvo que cambiar el orden determinado por la progresión de las masas atómicas y dejar vacías algunas celdas. Estaba convencido de que con el tiempo se descubrirían los elementos que faltaban, lo que confirmaría la validez de su teoría. Llegó incluso a predecir las propiedades de tres elementos ausentes basándose en las propiedades de cuatro elementos vecinos, que denominó provisionalmente eka-aluminio, eka-boro y eka-silicio. Entre 1875 y 1886 se descubrieron estos tres elementos (galio, escandio y germanio). Cada uno de ellos poseía las propiedades predichas por el químico ruso. Hasta entonces, muy pocos científicos aceptaban las ideas de Mendeléyev. Pero cuando se descubrieron estos elementos predichos por Mendeléiev, con propiedades muy similares a las que él había predicho, los científicos reconocieron la utilidad de su tabla. | |
Cómo leer la tabla
Las filas horizontales de la tabla periódica forman los períodos. Los electrones de los elementos de un periodo se distribuyen en el mismo número de capas de electrones, un número dado por el número del periodo.
Las columnas verticales forman las familias. Los elementos que pertenecen a una misma familia comparten ciertas características.
Esto significa que propiedades químicas similares se repiten periódicamente, de ahí el nombre de tabla periódica.
He aquí los nombres de las cuatro principales familias químicas:
- Los álcalis se encuentran en el extremo izquierdo de la tabla. Todos los elementos de esta familia química tienen en común una gran reactividad con los no metales y el agua. Cuando reaccionan con el agua, forman un álcali, de ahí su nombre. Son metales blandos, ligeros y de aspecto plateado. No se encuentran puros en la naturaleza; siempre están combinados con otros elementos.
- Los metales alcalinotérreos se encuentran a la derecha de la familia de los alcalinos. Tienen propiedades alcalinas en disolución y se encuentran en muchas rocas. Son sólidos de color gris metálico. Son similares a los álcalis, pero más duros y menos reactivos.
- Los gases inertes o gases raros se encuentran en la última columna de la tabla periódica. Todos estos elementos tienen una reactividad química casi nula con los demás elementos. Se caracterizan por una estabilidad química muy elevada gracias a sus capas electrónicas saturadas. Incoloros en estado natural, emiten colores característicos en tubos de vacío.
- Los halógenos se encuentran en la columna izquierda de los gases inertes. Son tan reactivos que sólo se encuentran en estado combinado en la naturaleza. Esta familia toma su nombre de una palabra griega que significa "generadores de sales". De hecho, forman sales con los álcalis y producen ácidos fuertes con el hidrógeno.
El hidrógeno está por encima de la familia de los álcalis. De hecho, no pertenece a ninguna familia química. Es un elemento único que puede comportarse como un álcali y a veces como un halógeno.
Las demás familias químicas se designan con el nombre del primer elemento en la parte superior de la columna de la tabla periódica. También se puede utilizar el número romano y la letra (a o B) que aparecen en la parte superior de las columnas de la tabla.